A termodinâmica é o ramo da física que estuda as relações entre o calor trocado, representado pela letra Q, e o trabalho realizado, representado pela letra τ, num determinado processo físico que envolve a presença de um corpo e/ou sistema e o meio exterior. É através das variações de temperatura, pressão e volume, que a física busca compreender o comportamento e as transformações que ocorrem na natureza.
Calor é energia térmica em trânsito, que ocorre em razão das diferenças de temperatura existentes entre os corpos ou sistemas envolvidos.
Energia é a capacidade que um corpo tem de realizar trabalho.
A termodinâmica tem como principais pontos o estudo de duas leis, que são:
- Primeira Lei da Termodinâmica: essa lei diz que a variação da energia interna de um sistema pode ser expressa através da diferença entre o calor trocado com o meio externo e o trabalho realizado por ele durante uma determinada transformação.
As transformações que são estudadas na primeira lei da termodinâmica são:
Transformação isobárica: ocorre à pressão constante, podendo variar somente o volume e a temperatura;
Transformação isotérmica: ocorre à temperatura constante, variando somente as grandezas de pressão e volume;
Transformação isocórica ou isovolumétrica: ocorre à volume constante, variando somente as grandezas de pressão e temperatura;
Transformação adiabática: é a transformação gasosa na qual o gás não troca calor com o meio externo, seja porque ele está termicamente isolado ou porque o processo ocorre de forma tão rápida que o calor trocado é desprezível.
- Segunda Lei da Termodinâmica: enunciada pelo físico francês Sadi Carnot, essa lei faz restrições para as transformações realizadas pelas máquinas térmicas como, por exemplo, o motor de uma geladeira. Seu enunciado, segundo Carnot, diz que:
Para que um sistema realize conversões de calor em trabalho, ele deve realizar ciclos entre uma fonte quente e fria, isso de forma contínua. A cada ciclo é retirada uma quantidade de calor da fonte quente, que é parcialmente convertida em trabalho e a quantidade de calor restante é rejeitada para a fonte fria.
Jackson Silva
Calor é energia térmica em trânsito, que ocorre em razão das diferenças de temperatura existentes entre os corpos ou sistemas envolvidos.
Energia é a capacidade que um corpo tem de realizar trabalho.
A termodinâmica tem como principais pontos o estudo de duas leis, que são:
- Primeira Lei da Termodinâmica: essa lei diz que a variação da energia interna de um sistema pode ser expressa através da diferença entre o calor trocado com o meio externo e o trabalho realizado por ele durante uma determinada transformação.
Termodinâmica
Transformação isobárica: ocorre à pressão constante, podendo variar somente o volume e a temperatura;
Transformação isotérmica: ocorre à temperatura constante, variando somente as grandezas de pressão e volume;
Transformação isocórica ou isovolumétrica: ocorre à volume constante, variando somente as grandezas de pressão e temperatura;
Transformação adiabática: é a transformação gasosa na qual o gás não troca calor com o meio externo, seja porque ele está termicamente isolado ou porque o processo ocorre de forma tão rápida que o calor trocado é desprezível.
- Segunda Lei da Termodinâmica: enunciada pelo físico francês Sadi Carnot, essa lei faz restrições para as transformações realizadas pelas máquinas térmicas como, por exemplo, o motor de uma geladeira. Seu enunciado, segundo Carnot, diz que:
Para que um sistema realize conversões de calor em trabalho, ele deve realizar ciclos entre uma fonte quente e fria, isso de forma contínua. A cada ciclo é retirada uma quantidade de calor da fonte quente, que é parcialmente convertida em trabalho e a quantidade de calor restante é rejeitada para a fonte fria.
Questões - Termodinâmica
1. Qual a energia interna de 1,5 mols de um gás perfeito na temperatura de 20°C? Considere R=8,31 J/mol.K.
Primeiramente deve-se converter a temperatura da escala Celsius para Kelvin:
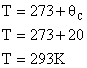
A partir daí basta aplicar os dados na equação da energia interna:
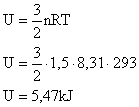
2. Qual a energia interna de 3m³ de gás ideal sob pressão de 0,5atm?
Neste caso devemos usar a equação da energia interna juntamente com a equação de Clapeyron, assim:
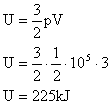 |
02. Tendo em vista a transformação gasosa acima descrita, assinale o que for correto:
01) O produto nR varia entre 0,10atm . R/K e 0,050atm . R/K.
x02) A pressão final do gás foi de 1,0atm.
04) A densidade do gás permaneceu constante.
08) O produto nR tem um valor constante de 0,050atm . R/K.
16) O produto nR tem um valor constante de 50atm.cm3/K.
x32) A densidade final do gás foi de 50% do valor inicial.
04. Tendo em vista a transformação gasosa acima descrita, assinale o que for correto:
x01) Na transformação, a densidade do gás é diretamente proporcional à pressão.
x02) A energia interna permaneceu constante.
x04) O sistema trocou calor com o meio ambiente.
08) Como a temperatura permaneceu constante, o sistema não trocou calor com o meio ambiente.
16) A energia interna aumentou.
x32) A quantidade de calor recebida é igual ao trabalho realizado pelo gás na expansão.
64) A quantidade de calor trocado e o trabalho realizado são ambos nulos.
05. Um gás ideal recebe calor e fornece trabalho após uma das transformações:
a) adiabática e isobárica.
b) isométrica e isotérmica.
c) isotérmica e adiabática.
xd) isobárica e isotérmica.
e) isométrica e adiabática.
Fonte: http://www.brasilescola.com/fisica/termodinamica.htmJackson Silva






agora faça um resumo do que vc entendeu e formule no minimo 5 questões com resolução seu prazo para isso estende-se ate o dia 14 de outubro ás 10:00 hs da manhã
ResponderExcluir